NOME DO PROFESSOR: ALLAN DE ALMEIDA SILVA.
DISCIPLINA: QUÍMICA.
SÉRIES: 3ºA, 3ºB, 3ºC.
SALAS: 9, 10 e 12.
ASSUNTO: ESCALA DE pH.
DATA DA POSTAGEM: 11/11/2020
DATA DA DEVOLUTIVA: 18/11/2020.
ENTREGAR VIA: GOOGLE SALA DE AULA ou EMAIL INSTITUCIONAL: almeidaallan985@gmail.com.
ESCOLA ESTADUAL ALFREDO INACIO TRINDADE.
Nome: Número: Série:
Atividade Avaliativa de Química.
Questão 1 – (UFV) O equilíbrio de ionização da água pura é dado pela equação abaixo, cuja constante do produto iônico (Kw) é 2,5×10–14, a 37 ºC.
H2O ↔ H+ + OH–
Assinale a alternativa que indica CORRETAMENTE o valor de pH da água pura nessa temperatura: (Dado: log101,58 = 0,2)
a) 7,0
H2O ↔ H+ + OH–
Assinale a alternativa que indica CORRETAMENTE o valor de pH da água pura nessa temperatura: (Dado: log101,58 = 0,2)
a) 7,0
b) 6,8
c) 7,8
c) 7,8
d) 9,0
e) 5,0.
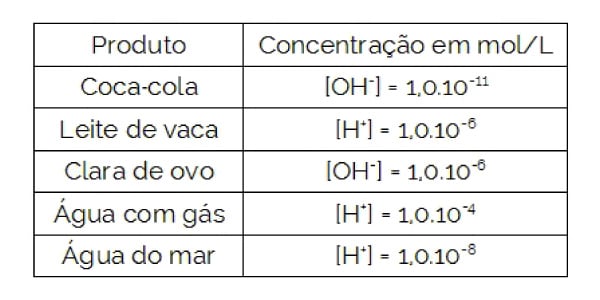
Questão 2 – (ESCS-DF) A tabela a seguir fornece a concentração hidrogeniônica ou hidroxiliônica a 25°C, em mol/L, de alguns produtos:

Com base nesses dados, NÃO é correto afirmar que:
a) a água do mar tem pOH = 6;
b) a água com gás tem pH maior do que a Coca-Cola e menor do que o leite de vaca;
c) a água do mar tem pH básico;
d) a clara de ovo é mais básica que o leite de vaca;
e) a clara de ovo tem maior pH do que a água do mar.
Questão 3 – (UnB-DF) Os sistemas químicos baseiam-se em algumas características. Os sistemas ácidos caracterizam-se pela liberação de íon hidrônio,H3O1+(aq). Os sistemas básicos baseiam-se na liberação de íon hidroxila, OH –(aq). A tabela a seguir mostra a característica de alguns sistemas.
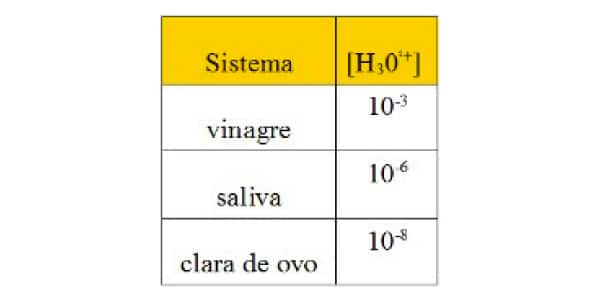
Tabela em exercício de pH
Considerando os sistemas citados, 100% ionizados, julgue os itens abaixo.
I. Todos os sistemas são formados por substâncias ácidas.
II. O pOH da saliva é igual a 6.
III. O vinagre é mais ácido que a clara de ovo.
IV. O pH do vinagre é igual a 3.
V. Acrescentando uma gota de vinagre a uma gota de saliva, a solução se tornará neutra.
Quais dos itens são FALSOS?
a) a água do mar tem pOH = 6;
b) a água com gás tem pH maior do que a Coca-Cola e menor do que o leite de vaca;
c) a água do mar tem pH básico;
d) a clara de ovo é mais básica que o leite de vaca;
e) a clara de ovo tem maior pH do que a água do mar.
Questão 3 – (UnB-DF) Os sistemas químicos baseiam-se em algumas características. Os sistemas ácidos caracterizam-se pela liberação de íon hidrônio,H3O1+(aq). Os sistemas básicos baseiam-se na liberação de íon hidroxila, OH –(aq). A tabela a seguir mostra a característica de alguns sistemas.

Tabela em exercício de pH
Considerando os sistemas citados, 100% ionizados, julgue os itens abaixo.
I. Todos os sistemas são formados por substâncias ácidas.
II. O pOH da saliva é igual a 6.
III. O vinagre é mais ácido que a clara de ovo.
IV. O pH do vinagre é igual a 3.
V. Acrescentando uma gota de vinagre a uma gota de saliva, a solução se tornará neutra.
Quais dos itens são FALSOS?
a) I, III e IV
b) II, III, IV e V
c) I e III.
d) III e IV.
e) I, II e V
b) II, III, IV e V
c) I e III.
d) III e IV.
e) I, II e V
Questão 4 – (UFPE)A concentração hidrogeniônica do suco de limão puro é 10-3 mol/L. Qual o pH de um refresco preparado com 20 mL de suco de limão e água suficiente para completar 200 mL?
a) 2,5
b) 3,0
c) 3,5
d) 4,0
e) 4,5
b) 3,0
c) 3,5
d) 4,0
e) 4,5
Questão 5 – (Fuvest) A autoionização da água é uma reação endotérmica. Um estudante mediu o pH da água recém destilada, isenta de CO2 e a 50 °C, encontrando o valor 6,6. Desconfiado de que o aparelho de medida estivesse com defeito, pois esperava o valor 7,0, consultou um colega que fez as seguintes afirmações:
(I) seu valor (6,6) pode estar correto, pois 7,0 é o pH da água pura, porém a 25 °C;
(II) a aplicação do princípio de Le Chatelier ao equilíbrio da ionização da água justifica que, com o aumento da temperatura, aumente a concentração de H+ ;
(III) na água, o pH é tanto menor quanto maior a concentração de H+ .
(II) a aplicação do princípio de Le Chatelier ao equilíbrio da ionização da água justifica que, com o aumento da temperatura, aumente a concentração de H+ ;
(III) na água, o pH é tanto menor quanto maior a concentração de H+ .
Está CORRETO o que se afirma
a) somente em I.
b) somente em II.
c) somente em III.
d) somente em I e II.
a) somente em I.
b) somente em II.
c) somente em III.
d) somente em I e II.
e) somente I e III.
Questão 6 - (Fuvest) A autoionização da água é uma reação endotérmica. Um estudante mediu o pH da água recém destilada, isenta de CO2 e a 50 °C, encontrando o valor 6,6. Desconfiado de que o aparelho de medida estivesse com defeito, pois esperava o valor 7,0, consultou um colega que fez as seguintes afirmações:
(I) seu valor (6,6) pode estar correto, pois 7,0 é o pH da água pura, porém a 25 °C;
(II) a aplicação do princípio de Le Chatelier ao equilíbrio da ionização da água justifica que, com o aumento da temperatura, aumente a concentração de H+ ;
(III) na água, o pH é tanto menor quanto maior a concentração de H+ .
Está correto o que se afirma
a) somente em I.
b) somente em II.
c) somente em III.
d) somente em I e II.
e) em I, II e III.
(I) seu valor (6,6) pode estar correto, pois 7,0 é o pH da água pura, porém a 25 °C;
(II) a aplicação do princípio de Le Chatelier ao equilíbrio da ionização da água justifica que, com o aumento da temperatura, aumente a concentração de H+ ;
(III) na água, o pH é tanto menor quanto maior a concentração de H+ .
Está correto o que se afirma
a) somente em I.
b) somente em II.
c) somente em III.
d) somente em I e II.
e) em I, II e III.
Questão 7 - (UFRGS) Se a 10 mL de uma solução aquosa de pH = 4,0 forem adicionados 90 mL de água, o pH da solução resultante será igual:
a) 0,4
b) 3,0
c) 4,0
d) 5,0
e) 5,5
a) 0,4
b) 3,0
c) 4,0
d) 5,0
e) 5,5
Questão 8 - (Vunesp) A 25 °C, o pOH de uma solução de ácido clorídrico, de concentração 0,10 mol/L, admitindo-se ionização total do ácido, é: Dados (a 25 °C): [H+ ] [OH- ] = 1,0 · 10-14; pOH = -log [OH-
a) 10-13
b) 10-1
c) 1
d) 7
e) 13
a) 10-13
b) 10-1
c) 1
d) 7
e) 13
Questão 9 - (Enem/2014) Visando minimizar impactos ambientais, a legislação brasileira determina que resíduos químicos lançados diretamente no corpo receptor tenham pH entre 5,0 e 9,0. Um resíduo líquido aquoso gerado em um processo industrial tem concentração de íons hidroxila igual a 1,0 x 10-10 mol/L. Para atender a legislação, um químico separou as seguintes substâncias, disponibilizadas no almoxarifado da empresa: CH3COOH, Na2SO4, CH3OH, K2CO3 e NH4Cl.
Para que o resíduo possa ser lançado diretamente no corpo receptor, qual substância poderia ser empregada no ajuste do pH?
a) CH3COOH
b) Na2SO4
c) CH3OH
d) K2CO3
e) NH4Cl
Questão 10 - (Enem/2010) Decisão de asfaltamento da rodovia MG-010, acompanha da introdução de espécies exóticas, e a prática de incêndios criminosos, ameaçam o sofisticado ecossistema do campo rupestre da reserva da Serra do Espinhaço. As plantas nativas desta região, altamente adaptadas a uma alta concentração de alumínio, que inibe o crescimento das raízes e dificultam a absorção de nutrientes e água, estão sendo substituídas por espécies invasoras que não teriam naturalmente adaptação para este ambiente, no entanto elas estão dominando as margens da rodovia, equivocadamente chamada de "estrada ecológica". Possivelmente a entrada de espécies de plantas exóticas neste ambiente foi provocada pelo uso, neste empreendimento, de um tipo de asfalto (cimento-solo), que possui uma mistura rica em cálcio, que causou modificações químicas aos solos adjacentes à rodovia MG-010.
Scientific American. Brasil. Ano 7, nº 79. 2008 (adaptado).
Essa afirmação baseia-se no uso de cimento-solo, mistura rica em cálcio que
a) inibe a toxicidade do alumínio, elevando o pH dessas áreas.
b) inibe a toxicidade do alumínio, reduzindo o pH dessas áreas.
c) aumenta a toxicidade do alumínio, elevando o pH dessas áreas.
d) aumenta a toxicidade do alumínio, reduzindo o pH dessas áreas.
e) neutraliza a toxicidade do alumínio, reduzindo o pH dessas áreas.
Para que o resíduo possa ser lançado diretamente no corpo receptor, qual substância poderia ser empregada no ajuste do pH?
a) CH3COOH
b) Na2SO4
c) CH3OH
d) K2CO3
e) NH4Cl
Questão 10 - (Enem/2010) Decisão de asfaltamento da rodovia MG-010, acompanha da introdução de espécies exóticas, e a prática de incêndios criminosos, ameaçam o sofisticado ecossistema do campo rupestre da reserva da Serra do Espinhaço. As plantas nativas desta região, altamente adaptadas a uma alta concentração de alumínio, que inibe o crescimento das raízes e dificultam a absorção de nutrientes e água, estão sendo substituídas por espécies invasoras que não teriam naturalmente adaptação para este ambiente, no entanto elas estão dominando as margens da rodovia, equivocadamente chamada de "estrada ecológica". Possivelmente a entrada de espécies de plantas exóticas neste ambiente foi provocada pelo uso, neste empreendimento, de um tipo de asfalto (cimento-solo), que possui uma mistura rica em cálcio, que causou modificações químicas aos solos adjacentes à rodovia MG-010.
Scientific American. Brasil. Ano 7, nº 79. 2008 (adaptado).
Essa afirmação baseia-se no uso de cimento-solo, mistura rica em cálcio que
a) inibe a toxicidade do alumínio, elevando o pH dessas áreas.
b) inibe a toxicidade do alumínio, reduzindo o pH dessas áreas.
c) aumenta a toxicidade do alumínio, elevando o pH dessas áreas.
d) aumenta a toxicidade do alumínio, reduzindo o pH dessas áreas.
e) neutraliza a toxicidade do alumínio, reduzindo o pH dessas áreas.
Comentários
Postar um comentário